|
「新英格蘭醫學」(New England Journal of Medicine)網路期刊和美國臨床腫瘤醫學會(American Society of Clinical Oncology)發表的一項跨國研究發現,英國藥廠阿斯特捷利康公司 (AstraZeneca PLC) 與美國藥廠默克公司 (Merck & Co.) 銷售的藥物Lynparza,可減少早期具侵襲性乳癌女性患者的癌症復發機率。 這項長期研究是遺傳性癌症治療的最新發展,為人類對抗遺傳性乳癌增添生力軍;也證明製藥業花在新型藥物PARP抑製劑方面的昂貴投資,是值得的。 Lynparza藥在美國定價為每位患者每月1萬4449元,是阿斯特捷利康公司最暢銷產品之一,主要用於治療晚期BRCA基因突變乳癌;去年銷售額達18億元。其競爭對手葛蘭素史克(GlaxoSmithKline)2019年斥資逾50億元收購另一款PARP抑製劑Tesaro製藥廠。 阿斯特捷利康癌症部門執行副總裁弗雷德里克森(David Fredrickson)表示,阿斯特捷利康將把研究數據提交監管機構,請求批准將Lynparza用於早期BRCA基因突變乳癌治療。 PARP抑製劑的作用是截斷癌細胞修復自身DNA能力,並導致癌細胞死亡。近年來,衛生監管機構已批准此類藥物用於治療卵巢癌、乳癌、前列腺癌和胰腺癌。目前發現這些藥物對BRCA1和BRCA2基因突變癌症,特別有用。 有BRCA基因突變的女性,罹患乳癌風險更高且通常更年輕。基因突變約占美國每年確診28萬1000椿乳癌病例的5%。根據美國癌症協會數據,乳癌是女性罹癌死亡第二大原因,每年在美國造成約4萬3600人死亡。美國食品藥物管理局(FDA)已在2018年批准使用Lynparza治療晚期的BRCA基因突變乳癌。 治療3年 近86%未復發 此項研究從2014年開始,在美國和其他22個國家/地區有1836名罹患早期BRCA1或 BRCA2乳癌的女性,在參加研究前均接受過切除腫瘤手術,並在手術前後接受防止腫瘤復發的化療。根據腫瘤大小或存在於淋巴結的癌症情況,她們的復發風險都很高。 研究隨機分配一半女性每天服用Lynparza藥劑一年,另一半服用安慰劑;研究人員發現,治療開始後2年半的中位隨訪期內,與安慰劑相比,Lynparza降低了42%癌症復發或任何原因死亡的綜合風險。治療三年後,接受Lynparza治療的女性85.9%沒有復發,接受安慰劑的女性77.1%未復發。 以上文章內容摘自世界新聞網。www.worldjournal.com/wj/story/121187/5511226 Adjuvant Olaparib for Patients with BRCA1- or BRCA2-Mutated Breast Cancer Abstract
BACKGROUND Poly(adenosine diphosphate–ribose) polymerase inhibitors target cancers with defects in homologous recombination repair by synthetic lethality. New therapies are needed to reduce recurrence in patients with BRCA1 or BRCA2 germline mutation–associated early breast cancer. METHODS We conducted a phase 3, double-blind, randomized trial involving patients with human epidermal growth factor receptor 2 (HER2)–negative early breast cancer with BRCA1 or BRCA2 germline pathogenic or likely pathogenic variants and high-risk clinicopathological factors who had received local treatment and neoadjuvant or adjuvant chemotherapy. Patients were randomly assigned (in a 1:1 ratio) to 1 year of oral olaparib or placebo. The primary end point was invasive disease–free survival. RESULTS A total of 1836 patients underwent randomization. At a prespecified event-driven interim analysis with a median follow-up of 2.5 years, the 3-year invasive disease–free survival was 85.9% in the olaparib group and 77.1% in the placebo group (difference, 8.8 percentage points; 95% confidence interval [CI], 4.5 to 13.0; hazard ratio for invasive disease or death, 0.58; 99.5% CI, 0.41 to 0.82; P<0.001). The 3-year distant disease–free survival was 87.5% in the olaparib group and 80.4% in the placebo group (difference, 7.1 percentage points; 95% CI, 3.0 to 11.1; hazard ratio for distant disease or death, 0.57; 99.5% CI, 0.39 to 0.83; P<0.001). Olaparib was associated with fewer deaths than placebo (59 and 86, respectively) (hazard ratio, 0.68; 99% CI, 0.44 to 1.05; P=0.02); however, the between-group difference was not significant at an interim-analysis boundary of a P value of less than 0.01. Safety data were consistent with known side effects of olaparib, with no excess serious adverse events or adverse events of special interest. CONCLUSIONS Among patients with high-risk, HER2-negative early breast cancer and germline BRCA1 or BRCA2 pathogenic or likely pathogenic variants, adjuvant olaparib after completion of local treatment and neoadjuvant or adjuvant chemotherapy was associated with significantly longer survival free of invasive or distant disease than was placebo. Olaparib had limited effects on global patient-reported quality of life. (Funded by the National Cancer Institute and AstraZeneca; OlympiA ClinicalTrials.gov number, NCT02032823. opens in new tab.) 原文出處:NEJM(www.nejm.org/doi/full/10.1056/NEJMoa21052155)
0 評論
美國聯邦食品暨藥物管理局 (FDA) 4日核准一款糖尿病藥物Wegovy在美國販售,稱此藥可協助肥胖症患者進行長期減重;根據該藥物研究報告指出,使用Wegovy的試驗者平均減重15%,大約是34磅(15.3公斤)。 研究報告顯示,服用該藥物的受測者可在14個月內維持體重下滑,直到體重變化趨於穩定;至於服用安慰劑的對照組,受測者體重平均只減少2.5%,不超過六磅。 協助該藥物研究報告、路易維爾代謝與動脈粥狀硬化研究中心(Louisville Metabolic and Atherosclerosis Research Center)醫學主任貝斯(Harold Bays)表示:「市面上目前有的藥物只能幫助減重大約5%至10%,有時候甚至不到。」 全美罹患肥胖症的成人人口超過1億人,占比約三分之一;一般人若減重5%就能大幅改善行動力、高血壓、高血糖和膽固醇指數等健康問題;但貝斯表示,對肥胖症的患者來說,只減重5%是不夠的。 貝斯強調,比起一些初期用於治療肥胖症的藥物,Wegovy更加安全;Wegovy最常見的副作用包括腸胃不適、噁心、腹瀉和嘔吐,但這些症狀都會慢慢消退,但仍有5%的試驗者最終停止使用。 Wegovy對罹患特定甲狀腺瘤的患者具有潛在風險,因此不建議家族有甲狀腺瘤或內分泌瘤病史的人使用;此外,該藥物也會增加憂鬱症和胰臟發炎的風險。 Wegovy由丹麥藥廠諾和諾德(Novo Nordisk)研發,是一種用來抑制食慾的腸道激素,比另一款糖尿病用藥semaglutide的劑量還高;糖尿病患者每周使用一次Wegovy,並搭配飲食調整和運動達到減重的效果。 諾和諾德還未公布Wegovy的定價,但據稱和另一款減肥藥Saxenda的價格不相上下;Saxenda為每日注射,如果使用者沒有保險,一個月的費用在1300美元以上。(約39000元新台幣) 休士頓衛理公會醫院集團(Houston Methodist Hospitals)糖尿病首席醫師薩度(Archana Sadhu)表示,Wegovy的成效將取決於定價,因為有時候健保並不給付減肥藥物,定價太高恐怕使需要的人無法獲得。 以上文章內容摘自世界新聞網。www.worldjournal.com/wj/story/121617/5512354 提醒大家,此藥品在台灣尚未通過TFDA核准。 以下是美國FDA發表的新聞稿: (該新聞稿網址: https://www.fda.gov/news-events/press-announcements/fda-approves-new-drug-treatment-chronic-weight-management-first-2014) FDA Approves New Drug Treatment for Chronic Weight Management, First Since 2014 Today, the U.S. Food and Drug Administration approved Wegovy (semaglutide) injection (2.4 mg once weekly) for chronic weight management in adults with obesity or overweight with at least one weight-related condition (such as high blood pressure, type 2 diabetes, or high cholesterol), for use in addition to a reduced calorie diet and increased physical activity. This under-the-skin injection is the first approved drug for chronic weight management in adults with general obesity or overweight since 2014. The drug is indicated for chronic weight management in patients with a body mass index (BMI) of 27 kg/m2 or greater who have at least one weight-related ailment or in patients with a BMI of 30 kg/m2 or greater. “Today’s approval offers adults with obesity or overweight a beneficial new treatment option to incorporate into a weight management program,” said John Sharretts, M.D., deputy director of the Division of Diabetes, Lipid Disorders, and Obesity in the FDA’s Center for Drug Evaluation and Research. “FDA remains committed to facilitating the development and approval of additional safe and effective therapies for adults with obesity or overweight.” Approximately 70% of American adults have obesity or overweight. Having obesity or overweight is a serious health issue associated with some leading causes of death, including heart disease, stroke and diabetes, and is linked to an increased risk of certain types of cancer. Losing 5% to 10% of body weight through diet and exercise has been associated with a reduced risk of cardiovascular disease in adult patients with obesity or overweight. Wegovy works by mimicking a hormone called glucagon-like peptide-1 (GLP-1) that targets areas of the brain that regulate appetite and food intake. The medication dose must be increased gradually over 16 to 20 weeks to 2.4 mg once weekly to reduce gastrointestinal side effects. Wegovy should not be used in combination with other semaglutide-containing products, other GLP-1 receptor agonists, or other products intended for weight loss, including prescription drugs, over-the-counter drugs, or herbal products. Wegovy has not been studied in patients with a history of pancreatitis. Wegovy’s safety and efficacy were studied in four 68-week trials. Three were randomized, double-blind, placebo-controlled trials (including 16 weeks of dose increases) and one was a double-blind, placebo-controlled, randomized withdrawal trial in which patients receiving Wegovy either continued with the treatment or switched to a placebo. More than 2,600 patients received Wegovy for up to 68 weeks in these four studies and more than 1,500 patients received placebo. The largest placebo-controlled trial enrolled adults without diabetes. The average age at the start of the trial was 46 years and 74% of patients were female. The average body weight was 231 pounds (105 kg) and average BMI was 38 kg/m2. Individuals who received Wegovy lost an average of 12.4% of their initial body weight compared to individuals who received placebo. Another trial enrolled adults with type 2 diabetes. The average age was 55 years and 51% were female. The average body weight was 220 pounds (100 kg) and average BMI was 36 kg/m2. In this trial, individuals who received Wegovy lost 6.2% of their initial body weight compared to those who received placebo. The most common side effects of Wegovy include nausea, diarrhea, vomiting, constipation, abdominal (stomach) pain, headache, fatigue, dyspepsia (indigestion), dizziness, abdominal distension, eructation (belching), hypoglycemia (low blood sugar) in patients with type 2 diabetes, flatulence (gas buildup), gastroenteritis (an intestinal infection) and gastroesophageal reflux disease (a type of digestive disorder). The prescribing information for Wegovy contains a boxed warning to inform healthcare professionals and patients about the potential risk of thyroid C-cell tumors. Wegovy should not be used in patients with a personal or family history of medullary thyroid carcinoma or in patients with a rare condition called Multiple Endocrine Neoplasia syndrome type 2 (MEN 2). Wegovy should not be used in patients with a history of severe allergic reactions to semaglutide or any of the other components of Wegovy. Patients should stop Wegovy immediately and seek medical help if a severe allergic reaction is suspected. Wegovy also contains warnings for inflammation of the pancreas (pancreatitis), gallbladder problems (including gallstones), low blood sugar, acute kidney injury, diabetic retinopathy (damage to the eye's retina), increased heart rate and suicidal behavior or thinking. Patients should discuss with their healthcare professional if they have symptoms of pancreatitis or gallstones. If Wegovy is used with insulin or a substance that causes insulin secretion, patients should speak to their health care provider about potentially lowering the dose of insulin or the insulin-inducing drug to reduce the risk of low blood sugar. Healthcare providers should monitor patients with kidney disease, diabetic retinopathy and depression or suicidal behaviors or thoughts. The FDA granted the approval to Novo Nordisk. Semaglutide 1 mg injection (Ozempic) was first approved as a treatment for type 2 diabetes in 2017. Related Information NIH: Overweight & Obesity Statistics ### The FDA, an agency within the U.S. Department of Health and Human Services, protects the public health by assuring the safety, effectiveness, and security of human and veterinary drugs, vaccines and other biological products for human use, and medical devices. The agency also is responsible for the safety and security of our nation’s food supply, cosmetics, dietary supplements, products that give off electronic radiation, and for regulating tobacco products. 有關該藥品的詳細說明,僅供專業醫療人員閱覽,恕不對外開放。 此文合乎著作權法第50條規定:「以中央或地方機關或公法人之名義公開發表之著作,在合理範圍內,得重製、公開播送或公開傳輸。」
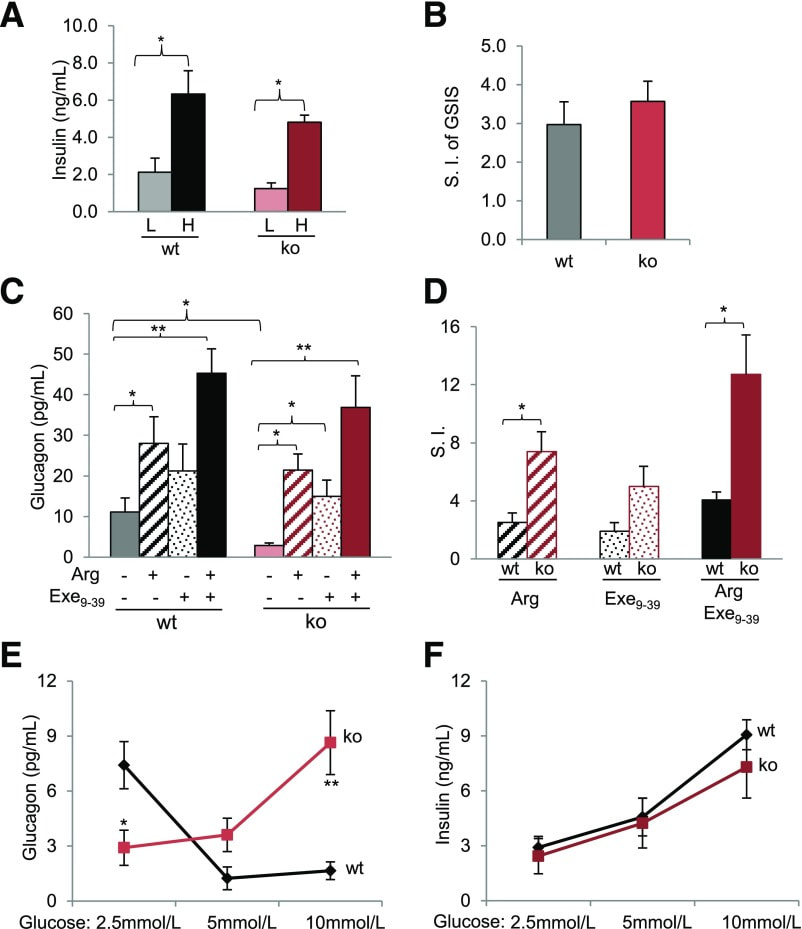
很多人問到關於GLP-1 RA的使用上,對於低血糖的副作用相對的非常少,到底是甚麼緣故呢? 根據美國糖尿病醫學會的這篇文獻來看,可以發現不論是原生的GLP-1或是GLP-1 RA,都可以雙向的刺激或是抑制α細胞,進而調控昇糖素。 也因此當血糖濃度較高時,會抑制α細胞,減少昇糖素分泌,同時刺激β細胞,增加胰島素分泌。 當血糖濃度較低時,則顛倒過來,變成刺激α細胞,增加昇糖素分泌,同時減少刺激β細胞,減少胰島素分泌。 如此一來幫助達到良好血糖控制,也不容易造成低血糖問題。 GLP-1 (via GLP-1R in α-cells) plays a bidirectional role, either stimulatory or inhibitory, in glucagon secretion depending on glucose levels. GLP-1(透過阿發細胞中的GLP-1R)根據血中葡萄糖濃度調控昇糖素分泌達到刺激或抑制作用 GLP-1 RA (包括 liraglutide, semaglutide, dulaglutide, 及 albiglutide) 更詳細內容 於專業人員區。 資料來源:GLP-1 Receptor in Pancreatic a-Cells Regulates Glucagon Secretion in a Glucose-Dependent Bidirectional Manner Isolated islets from αGLP-1R−/− mice show abnormal glucagon secretion in response to glucose. Islets were isolated from female mice, 3–4 months old, and used in these experiments. Shown are average data from at least three independent assays, which involved 8–10 mice/group. A: GSIS assay of islets isolated from the KO (ko) and WT (wt) mice. Low (L) glucose: 2.5 mmol/L; high (H) glucose: 16.5 mmol/L. B: The stimulation index (S.I.) of GSIS, which was calculated by dividing the insulin concentration at high glucose by that at low glucose. C: Arginine (Arg)-stimulated glucagon secretion assay, which used 20 mmol/L arginine and 100 nmol/L exendin9-39 (Exe9-39). D: Stimulation indexes for glucagon by arginine, exendin9-39, and both arginine and exendin9-39. Glucagon (E) and insulin (F) secretion in response to glucose levels of 2.5 mmol/L, 5 mmol/L, and 10 mmol/L. *P < 0.05; **P < 0.01.
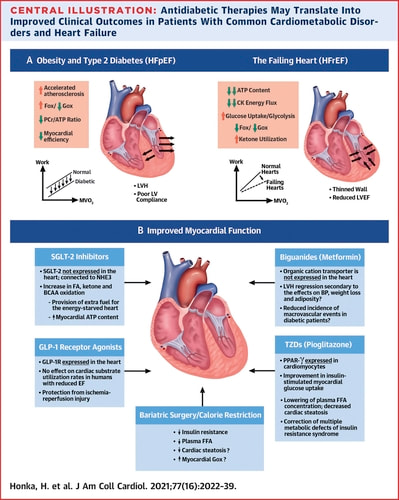
Therapeutic Manipulation of Myocardial Metabolism: JACC State-of-the-Art Review Henri Honka, Carolina Solis-Herrera, Curtis Triplitt, Luke Norton, Javed Butler, and Ralph A. DeFronzo J Am Coll Cardiol. 2021 Apr, 77 (16) 2022–2039 Abstract The mechanisms responsible for the positive and unexpected cardiovascular effects of sodium-glucose cotransporter-2 inhibitors and glucagon-like peptide-1 receptor agonists in patients with type 2 diabetes remain to be defined. It is likely that some of the beneficial cardiac effects of these antidiabetic drugs are mediated, in part, by altered myocardial metabolism. Common cardiometabolic disorders, including the metabolic (insulin resistance) syndrome and type 2 diabetes, are associated with altered substrate utilization and energy transduction by the myocardium, predisposing to the development of heart disease. Thus, the failing heart is characterized by a substrate shift toward glycolysis and ketone oxidation in an attempt to meet the high energetic demand of the constantly contracting heart. This review examines the metabolic pathways and clinical implications of myocardial substrate utilization in the normal heart and in cardiometabolic disorders, and discusses mechanisms by which antidiabetic drugs and metabolic interventions improve cardiac function in the failing heart. Highlights • Bioengineering of cardiac metabolism represents a novel strategy to improve cardiac function and slow the progression of myocardial disease. • Modification of myocardial metabolism by SGLT-2 inhibitors, GLP-1 RAs, and pioglitazone can reduce CV events in patients with type 2 diabetes. • The potential benefit of shifting fuel utilization pathways in patients with HF should be investigated in future trials. SGLT-2i和 GLP-1 RA在2型糖尿病患者中產生積極心血管保護作用的機制仍有待確定。這些抗糖尿病藥物之有益心臟作用可能是因改變心肌代謝所引導的。常見的代謝異常,包括代謝(胰島素阻抗)症候群和2型糖尿病,與心肌基質利用率和能量傳遞的改變有關,而導致易患心臟病。因此,衰竭的心臟的特徵在於基質之糖分解和酮氧化的轉變,產生更多高能量,以合乎衰竭的心肌需求。 重點摘要: 1、心臟代謝的生物工程學顯示一種改善心功能並減慢心肌疾病進展的新策略。 2、SGLT-2i,GLP-1 RA對心肌代謝的改變可以減少2型糖尿病病患者的心血管事件。 3、將來的試驗中應研究改變燃料利用途徑對心衰竭患者的潛在益處。 Metformin與心臟 臨床實驗,降低患有心血管疾病的重大不良心血管事件。(但臨床試驗者較少) 此部分可能還需要更多臨床受試者來提供數據。 Thiazolidinediones (TZDs)與胰島素阻抗症候群 臨床實驗,降低患有心血管疾病併有第二型糖尿病的重大不良心血管事件。 藉由改善左心室舒張漢收縮功能、改善胰島素刺激的葡萄糖吸收以及降低脂毒性並增加支防氧化。 SGLT-2i,(Thrifty Substrate Hypothesis) (包括 empagliflozin,canagliflozin和dapagliflozin) 臨床實驗,降低患有心血管疾病併有第二型糖尿病的重大不良心血管事件,也降低心衰竭的風險。 對於非第二型糖尿病併有心臟衰竭是指左心室射出率低下的的住院風險也有所降低。. 由於目前僅是假說,所以還等待更多醫學臨床的實證。 (可能是酮生成與心肌對酮的吸收變強,進而改善心肌功能) GLP-1 RA(包括 liraglutide, semaglutide, dulaglutide, 及 albiglutide)和心臟保護 臨床實驗,降低患有心血管疾病併有第二型糖尿病的重大不良心血管事件,也降低心衰竭的風險。 GLP-1 RA主要可防止缺血再灌注損傷,也可增加心跳,可歸因於刺激竇房結。如果心跳加快是由副交感神經刺激引起的,則可能是GLP-1 RA類對心臟的保護作用。 減肥手術/熱量限制 由於在現實中實現長期的飲食熱量限制是非常難,因此減肥手術後的結果雖然是初步的,但仍需進行長期的研究,以檢查手術引起的體重減輕對心功能和心衰竭的影響。 更詳細內容 於專業人員區。
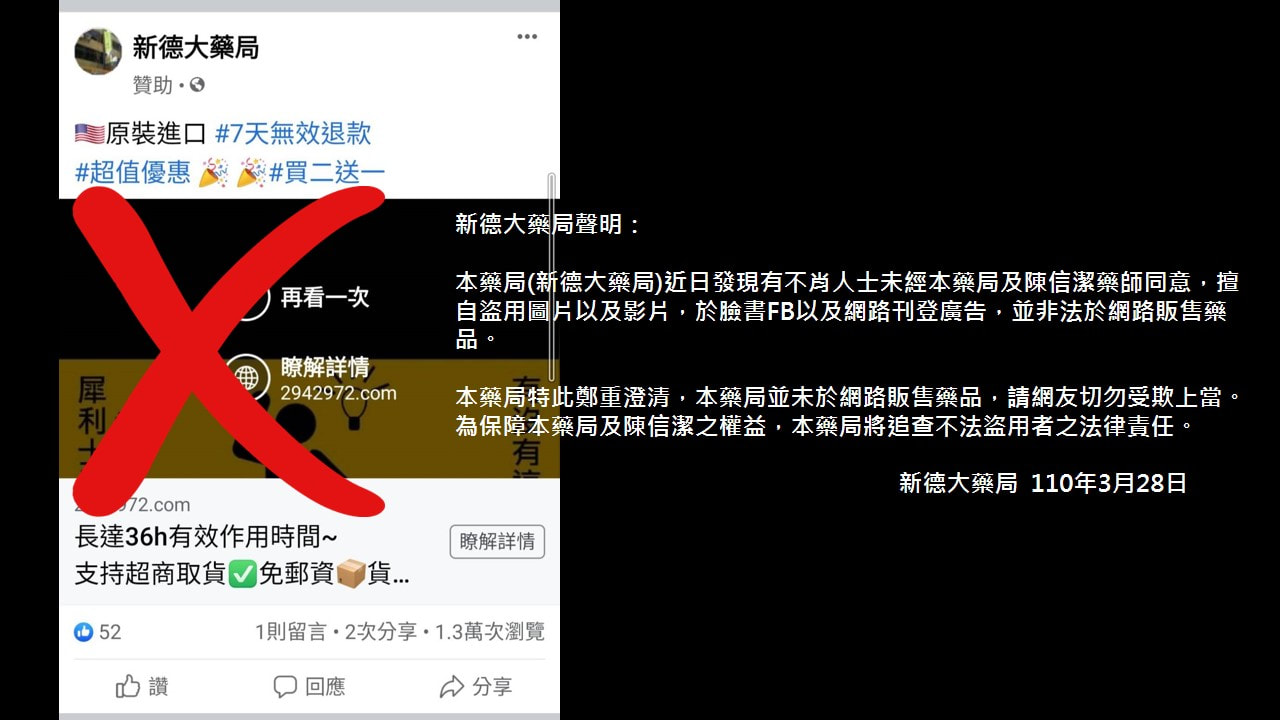
資料來源: J Am Coll Cardiol 2021, 77(16) 2022-2039 新德大藥局聲明:
本藥局(新德大藥局)近日發現有不肖人士未經本藥局及陳信潔藥師同意,擅自盜用圖片以及影片,於臉書FB以及網路刊登廣告,並非法於網路販售藥品。 本藥局特此鄭重澄清,本藥局並未於網路販售藥品,請網友切勿受欺上當。為保障本藥局及陳信潔之權益,本藥局將追查不法盜用者之法律責任。 新德大藥局 110年3月28日 《最值得關注的藥物預測》(Drugs to Watch)年度報告,在2021年已核准或即將核准的新藥和生物製劑中列出了4種可能暢銷的藥物,分別來自慢性、持續進展以及使人衰弱的疾病治療藥物:
阿茲海默症治療藥物--Aducanumab 全球約有5千萬名阿茲海默症患者,阿茲海默症患者通常在 65 歲以後才被診斷出來,但在出現症狀之前,病患的大腦往往退化已經數年、甚至數十年。 阿茲海默症患者的病徵是大腦出現病變,如「β澱粉類蛋白」異常聚集,這種現象多在患者出現阿茲海默症的明顯症狀前20年開始出現。由美國藥廠Biogen和Eisai共同開發的Aducanumab,主要是針對這些致病的機轉來進行標靶藥物開發,目標能緩解退化現象。 而Aducanumab被視為是最有機會不能通過的藥品,雖然在2020年7月向美國食藥局(FDA)申請上市,但之後卻被FDA認為證據不足。 最新進展是,Biogen和Eisai於今年1月底宣布,已接獲FDA延長生物製劑許可證申請(BLA)的通知,將盡力提供更多分析與臨床數據。 乾癬治療藥物--bimekizumab 乾癬的全球患病率約為2%-3%,並且可能引發身上其他的自體免疫疾病。由UCB研發的bimekizumab雖然上市時間較晚,但其療效優於目前的用藥,且嚴重副作用較少,因此預期該藥具有最佳療效。 前列腺癌口服藥--Relugolix 前列腺癌是全球男性的第二大常見惡性腫瘤,由武田研發的Relugolix是口服製劑首創(first-in-class)新藥,比起注射用的藥品相比,口服製劑更具優勢。同時,Relugolix也可用於治療困擾數百萬女性的子宮內膜異位症和子宮肌瘤,被看好能增加該藥品成功上市且大量使用的機率。 心衰竭治療藥物--Vericiguat 拜耳和默克聯合研發的Vericiguat是一種治療心衰竭的創新藥物,也是首款專門針對射血分數降低的慢性心衰竭(HFrEF)高危險族群的治療藥物。 這項報告在2021年達到臨床二期或以上階段的的藥物,製作出年度潛力暢銷藥物列表,並通過查詢年度報告、藥物產品線、臨床試驗、專利、化學資訊、交易、監管狀況等,對每種藥物進行了研究和評估。 Among new drugs and biologics that have either won approval or are on the cusp of doing so, Clarivate has identified four treatments that are likely to achieve blockbuster status, delivering annual sales of more than $1 billion, within five years. The 2021 Drugs to Watch include:
關鍵字:Aducanumab、阿滋海默症、Relugolix、前列腺癌、bimekizumab、乾癬、Vericiguat、心衰竭、CHF、Alzheimer、psoriasis 資料來源:Clarivate Drugs to Watch Report Highlights Four Likely Blockbusters Among Drugs Launching in 2021 https://clarivate.com/cortellis/news/clarivate-drugs-to-watch-report-highlights-four-likely-blockbusters-among-drugs-launching-in-2021/ 各項藥品之完整文章依主管機關相關規定,專業醫藥資訊僅提供醫藥專業人員參考(請申請核可通過後,即可閱讀專業人員區)。 恕不對外開放非專業人士使用。 若有任何問題或需要驗證通過專業人員區,都歡迎加官方LINE帳號(點此即可加入)詢問。 心衰竭是由於心髒結構,及/或功能異常,且證實利鈉肽 (Natriuretic peptide)升高,及/或肺或系統循環充血,而引起之臨床症候與症狀。 (3/1/2021 Journal of Cardiac Failure, European Journal of Heart Failure) 用白話文說,就是: 心衰竭是由於 1、心臟結構異常,或 2、心臟功能異常 且有: 1、利鈉肽 (Natriuretic peptide)升高,或 2、肺/系統循環鬱血 引起的臨床症狀/症候群。 這個定義來自於以下各國心臟學會達成的共識: 1、歐洲心臟學會的心衰竭協會 2、日本心衰竭學會 3、加拿大心衰竭學會 4、澳洲紐西蘭心臟學會 5、中國心衰竭協會 哈佛醫學院的Braunwald 及Antman 在該期刊社論也加以肯定。看來,這個定義是一統江湖的新主流了。 過去30年,心衰竭被定義為,心臟無法負荷新陳代謝所需而引起之症狀。相較之下,新定義確實著重於「心臟」因素。 特別注意的是,按照新定義,因為慢性腎病(CKD)所造成的水份滯留,並不包括在心衰竭之內。 心衰竭的階段分期(staging) 有了新定義,staging也跟著修改。 發生心衰竭風險(At-risk for HF)(A期): 病人有發生心衰竭風險,但以前或現在心臟並無結構或功能異常的症狀,也沒有利鈉肽升高的情形。 心衰竭前期(Pre-HF)(B期): 以前至目前無心衰竭症狀,但有心臟結構/功能異常存在,或利鈉肽升高情形。 心衰竭(C期):以前或現在已出現因為心臟結構/功能異常的症狀。 晚期(嚴重)心衰竭(Advanced HF)(D期): 病人在靜態休息時出現嚴重的症狀,經指引導向治療仍重覆住院,且需要進一步的治療,如換心,機械循環輔助,或緩和醫療(palliative)。 值得注意的是,心衰竭前期(Pre-HF)(B期)。這個概念就如同癌前期,仍然可以治療,可以預防的。就像糖尿病而且有心衰竭風險的病人,使用SGLT2 一樣。 面對使用左心室射出分率(LVEF)來分類心衰結治療,如低射出分率(HFrEF, Heart Failure with reduced ejection fraction),及正常射出分率(HFpEF, Heart Failure with Preserved Ejection Fraction), 新定義的心衰竭也有更新版的說法: 低EF的心衰竭(HFrEF):LVEF在40%以下 輕度低EF的心衰竭(HFmrEF):LVEF 41-49% 正常射出分率(HFpEF): LVEF大於50% 改善射出分率之心衰竭(HFimpEF):從基本EF小於等於40%,提升至少10點,且第二次測量之EF大於40% 最後一項的改善射出分率之心衰竭,觀念上是提醒人們,心衰竭治療後,是可以改善(improve)的,而不是恢復(recover)。 新定義是強調,心衰竭是連續演變的事情(continuum),而不是只去不回的單行道。 在治療角度觀之,過渡性的EF 改變,即使提升10-20%,如果沒有超過達到EF40%,治療策略不需要改變。如果EF升高超過40%,治療策略需要調整。 雖然論文發表時用的標題是《Universal Definition》Braunwald 認為新的定義還不能說全球共識,因為美國心臟協會(AHA)及美國心臟學院並未參與。 新定義還需時間考驗。 關鍵字:心衰竭、heart failure、高血壓、肺動脈高壓 資料來源: 臨床筆記 Universal definition and classification of heart failure. J Cardiac Fail 2021;00:1-27 若有任何問題或需要驗證通過專業人員區,都歡迎加官方LINE帳號(點此即可加入)詢問。 減肥筆(針)有三個名稱,分別是Liraglutide, Victoza和Saxenda,這三個都是同一個藥品成分,其中Liraglutide是藥物的學名,就是成分名。然後Victoza是商品名,這枝筆是用在第二型糖尿病的,裡面有三種劑量,分別是0.6mg, 1.2mg和1.8mg,三種劑量分別是糖尿病患使用的起始劑量、維持劑量和加強劑量。最後Saxenda則是專門使用在減肥上,劑量多了2.4mg和3.0mg。
Saxenda 3.0mg不管在減重百分比上,減輕體重5%或10%以上的達標率上,都高於安慰劑與Victoza 1.8mg,而一般定義有效的減重,為減輕原體重的5%到10%或以上,也因此能拿到減重適應症的適應症的只有Saxenda 3.0mg。 使用方式為皮下注射,一天一次,可使用在餐前或餐後,也不限白天或晚上,可以說相當方便,不過劑量上就得要慢慢往上調整,基本上是一週調整一次劑量,從0.6->1.2->1.8->2.4->3.0mg慢慢調,讓身體可以慢慢適應。 飲食上最好要配合『慢慢吃』的飲食方式,吃的速度慢下來,每吃一口都至少嚼20~30下,一餐進食時間超過20分鐘,才能減少不適感,因為這藥除了在腦部抑制食慾外,也會抑制胃的排空速度,好處就是飽足感可以持續較久,但是若是吃東西速度太快,可能會有延遲消化的不舒服感。 副作用方面,最大的副作用就是噁心(39.3%),其他為第二型糖尿病中低血糖症(23%)、腹瀉(20.9%)、便秘(19.4%)嘔吐(15.7%)、頭痛(13.6%)等。但還好可透過改變飲食模式去慢慢適應。 慢慢吃其實也是一種減肥飲食的好方法,善纖達剛好也輔助促使這種飲食模式,吃的更慢,吃的更少,但是飽足感更高。相對於近年來大家常吃的速食,這些速食通常都是高熱量且不需要大量咀嚼就可以吞嚥,雖在忙碌的生活中讓我們感到方便,但是通常沒太多飽足感, 因而需要再靠高熱量去填補,也因此造成更多肥胖的問題。 關鍵字:減肥筆、減肥針、Liraglutide,、Victoza、Saxenda、減重、減肥、胰妥善、善纖達 用於第2型糖尿病患者中的減重效果 Saxenda(liraglutide 3.0mg)已於日前2014年12月23日於美國FDA通過可以治療肥胖症,而此藥的1.8mg則本來就是在治療第2型糖尿病病患上,此研究確定Saxenda(liraglutide 3.0mg)在治療超重和肥胖的第2型糖尿病患者可以有效減輕體重。 目的:探討成人超重或肥胖和2型糖尿病的療效和利拉魯肽與安慰劑的安全性體重管理。 結論:在超重和肥胖的第2型糖尿病患者,採用皮下注射利拉魯肽(3.0毫克)的每日,與安慰劑相比,導致體重下降超過56週。需要進一步的研究,以評估長期療效和安全性。 資料來源: Efficacy of Liraglutide for Weight Loss Among Patients With Type 2 Diabetes The SCALE Diabetes Randomized Clinical Trial https://jamanetwork.com/journals/jama/fullarticle/2428956 完整文章依主管機關相關規定,專業醫藥資訊僅提供醫藥專業人員參考(請申請核可通過後,即可閱讀專業人員區)。 恕不對外開放非專業人士使用。 若有任何問題或需要驗證通過專業人員區,都歡迎加官方LINE帳號(點此即可加入)詢問。 經過一整個過年加上又到了228連假,不僅讓人很難收心好好工作,就連體重也變得難以掌控。連續假期大吃大喝讓身上肥肉重新出來見客,更不是上健身房一時半刻就能立刻回復窈窕身段。因為減重的關鍵不能光靠運動,是否有強大的意志力抵抗食慾的來襲才是關鍵。 新德大藥局陳信潔藥師表示,減重過程若只靠意志力叫自己少吃一直運動,根據自己多年的經驗,平均十個人會有七人失敗,且大約在100天左右就會破功,體重如溜溜球效應復胖回來。特別是BMI越高的肥胖患者,減重更是困難,加上壓在身上的體重負擔大,反而無法做激烈運動,要達到減重就更困難了。因此,建議減重者,可透過飲食控管及台灣合法的減重藥物輔助,搭配適合自己的輕量級運動,持續達到熱量赤字就能減重。 任何成功的減重管理計畫都需要考慮長期,除了協助減重,還要預防復胖。而目前台灣已有合法的減重藥物輔助治療,可明顯控制食慾,減少對於飲食慾望,不過使用前,建議要諮詢專業醫療團隊,評估個人狀況,制訂個人化體重管理計畫,才能順利體重達標。陳信潔也建議日常飲食控制如澱粉減半,同時多補充蛋白質,並且多食用白肉取代紅肉,餐與餐中間不要進食等等。從改變日常生活中的習慣開始,才是減重成功的不二法門。 若有任何問題或需要驗證通過專業人員區,都歡迎加官方LINE帳號(點此即可加入)詢問。 此文章依主管機關相關規定,專業醫藥資訊僅提供醫藥專業人員參考(請申請核可通過後,即可閱讀專業人員區)。 恕不對外開放非專業人士使用。 體重過重的肥胖者,常常伴隨三高等代謝疾病。過去減重方法,大都是透過生活習慣,或是藥物等,達到減少體重,但總是發現減少的不僅僅是脂肪,會連同肌肉一起減少。
減重過程中,減少脂肪與增加肌肉這兩件事,通常不容易同時達成。 進期JAMA Network Open期刊發表一篇文章,針對Activin第二型受體作用的單株抗體Bimagrumab,在第二型糖尿病過重或是肥胖的患者,使用48週時間,可以減少20%的體脂量,以及增加3.6%肌肉量,同時下降0.76%醣化血色素 重要性 激活素II型受體(ActRII)信號轉導的抗體阻斷可刺激骨骼肌生長。先前的臨床研究表明,單克隆抗體bimagrumab對ActRII的抑製作用還促進了多餘的脂肪組織損失並改善了胰島素抵抗。 目的 評估比格瑪單抗對2型糖尿病和超重和肥胖成年人身體成分和血糖控制的有效性和安全性。 設計,背景和參與者 這項雙重掩蔽,安慰劑對照,為期48週的2期隨機臨床試驗是在2型糖尿病,體重指數在28至40之間,糖化血紅蛋白(HbA 1c)水平在2至25歲之間的成年人中進行的。美國和英國的9個站點分別為6.5%和10.0%。該試驗於2017年2月至2019年5月進行。分析僅包括完成完整治療方案的參與者。 干預措施 患者每4週隨機接受Bimagrumab(10 mg / kg,最高1200 mg,於5%葡萄糖溶液中)靜脈內輸注或安慰劑(5%葡萄糖溶液),持續48週。兩組均接受飲食和運動諮詢。 主要結果和措施 主要終點是從基線到第48週的總體脂質量(FM)的最小二乘均值變化;次要和探索終點是從基線到第48週的瘦體重(LM),腰圍(WC),HbA 1c水平和體重(BW)變化。 結果 總共有75例患者被隨機分為bimagrumab(n = 37; 23名[62.2%]婦女)或安慰劑(n = 38; 12 [31.6%]名婦女);58名(77.3%)完成了為期48週的研究。基線時患者的平均(SD)年齡為60.4(7.7)歲;平均BMI為32.9(3.4);平均(SD)體重為93.6(14.9)千克; 平均(FM)FM為35.4(7.5)千克; 平均(SD)HbA 1c水平為7.8%(1.0%)。bimagrumab與安慰劑在第48週的變化如下:FM,-20.5%(-7.5 kg [80%CI,-8.3至-6.6 kg])vs -0.5%(-0.18 kg [80%CI,-0.99至-0.99 0.63公斤])(P <.001);LM,3.6%(1.70 kg [80%CI,1.1至2.3 kg])vs -0.8%(-0.4 kg [80%CI,-1.0至0.1 kg])(P <.001); WC,-9.0 cm(80%CI,-10.3至-7.7 cm)vs 0.5 cm(80%CI,-0.8至1.7 cm)(P <.001); 血紅蛋白1c級,-0.76個百分點(80%CI,-1.05至-0.48個百分點)vs-0.04個百分點(80%CI,-0.23至0.31個百分點)(P = 0.005); 和體重分別為-6.5%(-5.9 kg [80%CI,-7.1至-4.7 kg])和-0.8%(-0.8 kg [80%CI,-1.9至0.3 kg])(P <.001)。Bimagrumab的安全性和耐受性與先前的研究一致。 結論 使用每四週一次,每公斤10mg的Activin第二型受體單株抗體Bumagrumab,在48週時間可以減少7公斤體重,增加2公斤肌肉,下降0.80醣化血色素。 目前還在臨床試驗階段,有待造福更多的三高肥胖患者。 參考資料: https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2774903 https://www.medscape.com/viewarticle/944602 肥胖是許多人心中最軟最難面對的問題,生理上當然也是。看著自己的肚腩越來越大,任誰都會打擊到自信心,大概覺得這是人生中最難解決的毛病了吧。但這到底是不是生病呢? 事實上,就醫學定義「肥胖」的確是種疾病,根據衛福部公布的標準,只要BMI≧27 即為肥胖,24≦BMI<27 則為過重,可考慮接受臨床診斷及治療。 不過許多BMI沒超過此標準的人一樣常被肥胖問題所擾,眼看著蝴蝶袖和被油脂淹沒的腹肌沒法度,這時候到底該怎麼辦?沒有達到臨床肥胖的標準,那還可以去看門診尋求減肥協助嗎?或是可以上藥局尋求購買相關指示藥或保健食品嗎?有沒有替代療法?以下為您各自解答。 肥胖症:
倘若BMI確實達到24、甚至超過27,毫無疑問,就醫尋求專業協助才能正確解決問題,醫師可根據個案的生理需求以及生活習慣開立適當的藥品。 目前台灣經核准的減肥藥品主要有兩種,一是阻斷油脂吸收的藥品;另一種是抑制食慾中樞的藥品。 前者,顧名思義是透過阻斷體內油脂吸收到達體重控制目的,後者是抑制食慾增加飽足感的藥品,透過抑制食慾中樞,達到減少卡路里攝取而到達體重控制,但各有其優缺點,使用上仍有需多需注意之處。 以常見的2種要來舉例,羅鮮子Orlistat雖然在排油上效果非常好,仍有其使用限制,若是已吸收的油脂沒有辦法透過此藥排除;另外,此藥最多排除不超過30%的油脂吸收量,換言之,若油脂攝取偏少效果並不好,若油脂攝取過多,也只是減緩脂肪累積的程度,因此也不能因此肆無忌憚吃高油脂食物。(註:Orlistat 120mg的配方為處方藥,Orlistat 60mg則為藥師指示藥品。) 而善纖達SAXENDA雖然可以抑制食慾。但是許多人的飲食並不是建立在飢餓上,而可能是生活習慣或是各種壓力的發洩,對於這類病人來說,這個藥品使用效果就有可能打折。另外,肝腎功能不好、或是有在使用血糖藥、身心科藥品的個案,也不建議使用此藥品,以免因為藥品代謝、低血糖或是藥物間交互作用造成身體負擔。 一般肥胖 即使未到達肥胖症,仍有需多民眾認為自己有身形過胖、體重過重之問題而到社區藥局尋求協助,欲購買瀉藥或利尿劑這些網路上討論詢問度很高的藥品。 就學理而言,使用瀉藥或是利尿劑,確實可以因排泄物或水分排出達到體重減輕的效果,但此為一時,絕非長久之計,對於體重的控制更是十分不健康的作法。 市面上也有些保健食品含有之成分能針對油脂或是澱粉代謝做控制,不過效果因人而異,在不傷害身體的情況下酌量使用無虞,不過仍是治標不治本。 「開流節源」 無論是哪種肥胖問題,「開流節源」才是最實際的,怎麼透過改變生活習慣,透過了解自己的身體需求,攝取適合作息的食物類型以及食物量,配合運動才是最實際的。 運動的好處實在是不勝枚舉,可以增加腦內啡,增加新陳代謝、讓心情愉悅,有氧運動可以快速增加熱量燃燒,讓脂肪和掰掰袖快速離開,適度重量訓練可以增加肌力、減少關節負擔,更可以使身體緊實,創造線條,同時因為肌肉耗能高,更能提升基礎代謝率,讓你身體熱量消耗更快速。 當然,配合飲食控制,與營養專業人員討論適合您的飲食,能更快速找到被脂肪包覆住的美體。而如果您選擇配合醫師使用處方藥品或是藥師指示藥品,或更能達到事半功倍之效果,不過在使用藥品上若出現任何問題,也千萬不要偷懶,盡快詢問您的醫師及藥師。 相關關鍵字:糖尿病、胰島素、減肥、減重、減肥針、減肥藥 這幾年來糖尿病的治療進步很快,許多新的藥物在最近幾年當中,幫病人更能控制血糖,許多新型的口服藥物,也發揮了穩定血糖控制效果,讓病人光靠口服藥即可得到穩定的生活品質。 但是在近百年來,胰島素的角色仍然非常的重要,無論是作為血糖偏高時口服藥的即時救援,或者糖尿病初發病即時介入,控制血糖及保護胰臟僅存些微分泌胰島素的功能,都是醫學從研究上 熟知的領域。 所以如何正確注射胰島素的技巧是相當重要的。 最近的十多年以來,胰島素注射已經從傳統的針筒抽取,進展成為發達的筆針。而胰島素藥物的發展,在全世界藥廠百家爭鳴下,近幾年又加上了 GLP-1 受器刺激劑的藥物,也是重要的針劑藥物,除了能幫助控制血糖以外,也已經有些針劑藥物核准能輔助減重。 台灣糖尿病衛教學會,每隔一段時間就邀請資深衛教師進行胰島素注射指引的修訂,就是因應時代藥物的進步速度。也希望把胰島素注射,從醫院、診所、藥局的糖尿病專科醫師、糖尿病衛教師,推廣到一般科醫師、社區藥局的藥師都能夠接受的注射教育內容。 胰島素筆型注射液用藥指導 藥品成分名: 分類 商品名 中文名 藥效 劑量 胰島素類似物 Toujeo 糖德仕 長效 300U/mL,1.5mL 透明澄清 胰島素類似物 Lantus 蘭德仕 長效 100U/mL,3mL 透明澄清 胰島素類似物 Levemir 瑞和密爾 長效 100U/mL,3mL 透明澄清 FlexPen 諾易筆 胰島素類似物 NovoMix 30 諾和密斯 30 速效+中效 100U/mL,3mL 白色混濁 FlexPen 諾易筆 (30:70) 每次使用前務必使液體混 合均勻至白色雲霧狀 胰島素類似物 NovoMix 50 諾和密斯 50 速效+中效 100U/mL,3mL 透明澄清 FlexPen 諾易筆 (50:50) 胰島素類似物 NovoRapid 諾和瑞 速效 100U/mL,3mL 透明澄清 FlexPen 諾易筆 GLP-1類似物 Victoza 胰妥善 長效 6mg/mL,3mL 透明澄清 GLP-1類似物 TRULICITY 易週糖 長效 1.5mg/0.5mL,0.5mL 透明澄清 0.75mg/0.5mL,0.5mL 透明澄清 GLP-1類似物 Ozempic 胰妥讚 長效 1.34 MG/ML,1.5mL 透明澄清 1.34 MG/ML,3mL 透明澄清 GLP-1類似物 SAXENDA 善纖達 長效 6mg/mL,3mL 透明澄清 如何注射:
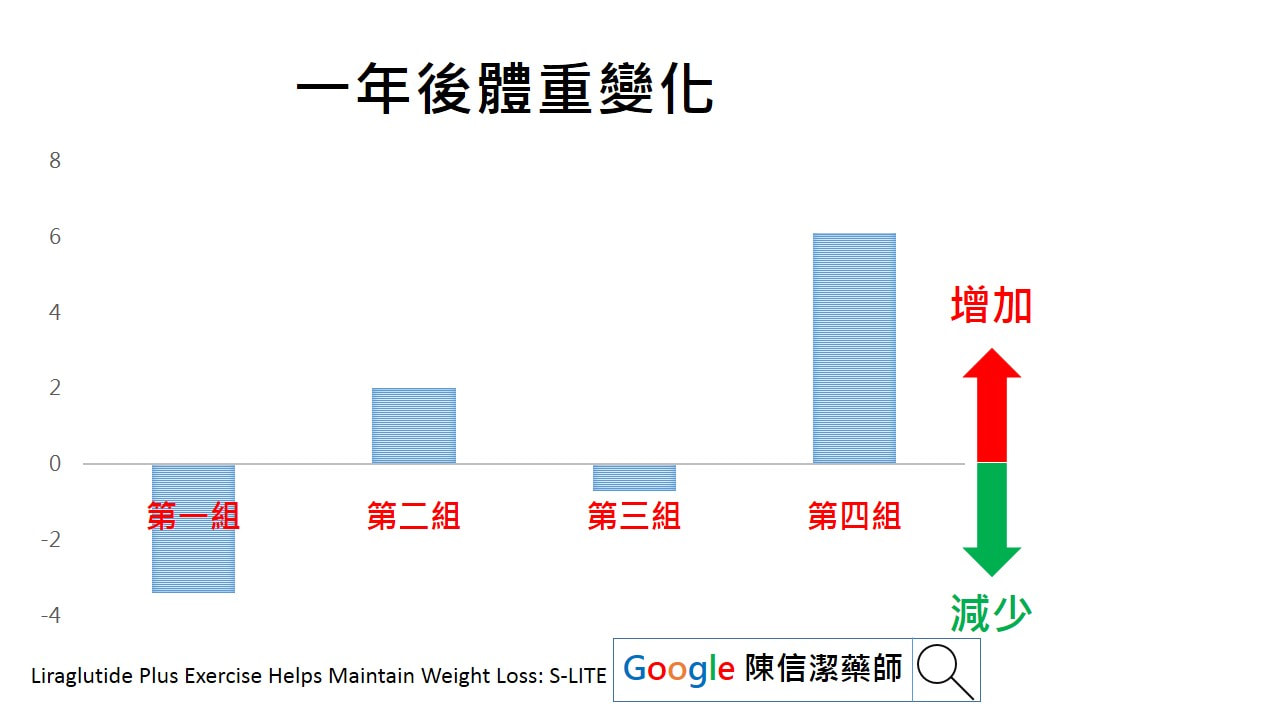
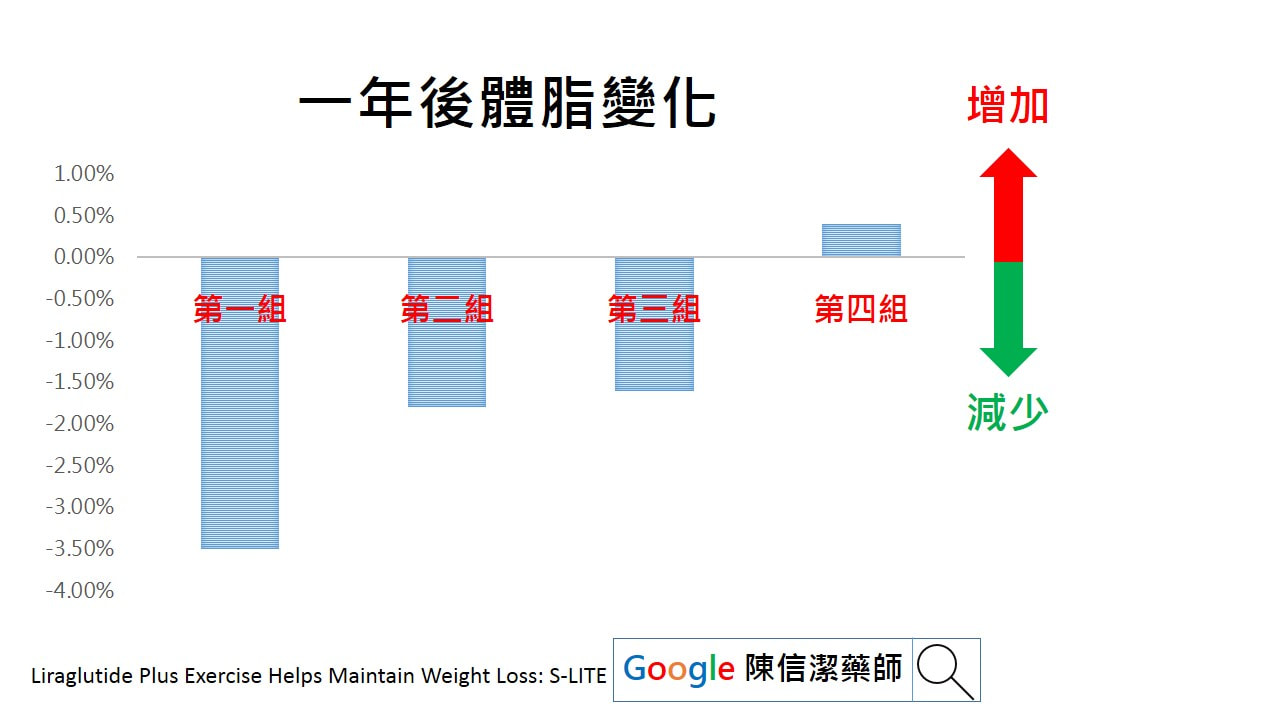
1. 請依照醫師指示的時間和劑量使用。 2. 本藥只能由皮下注射,不可靜脈注射,可選擇上臂背面、腹部、大腿外側及 3. 臀部上緣,注射部位必須輪替,同一個部位重複注射,易造成該部位壞死或萎縮(凹陷或變硬)及皮下脂肪增生。 4. 注射後,應停留 10 秒再將針頭取出,確保所有劑量注入和預防藥劑漏出。 注射部分若有疑問,也可以參考台灣胰島素注射指引。 台灣胰島素注射指 忘記使用藥品怎麼辦: 因各項胰島素使用時機及方法各有不同,建議撥打諮詢電話詢問藥師。切記不可一次施打雙倍的劑量。 服藥期間有哪些注意事項: 1. 服用降血糖藥物,飲食及運動要規律,服藥期間延遲飲食時間或增加運動量,可能會引起低血糖現象。 2. 注射劑的內容物若有結塊、結晶、變色或冷凍過,意味胰島素效能喪失,宜丟棄。 3. 每次使用前請洗手,並以酒精消毒注射部位。 4. 第一次使用的注射筆儲存於冰箱,請於注射前 1-2 小時先取出回復至室溫,冰冷的胰島素注射時會較疼痛。開封後的注射筆不要放入冰箱。 5. 若旋轉超過所需的劑量,反向旋轉至正確的劑量即可。 6. 注射後不可按摩注射部位,避免加速藥物吸收,導致血糖值起伏過大。 7. 每次注射都要使用新的無菌針頭,可以降低感染的風險,針頭重複使用容易使針頭阻塞,導致劑量不準確。 8. 若注射筆內剩餘的劑量不足,無法選取所需的劑量,可以將劑量分兩次注射或使用一支新的注射筆。 9. 針頭使用後請勿亂丟棄,請準備塑膠硬瓶,將廢棄針頭丟入瓶內,返院時交給醫療人員處理。 10. 未開封的注射筆應置於冰箱冷藏,不可冷凍。使用中可放在室溫陰涼處,並於一個月內用完,未用完的則須丟棄。旅行則置於隨身行李,避熱、避光。 可能的副作用及處理方式: 1. 如有低血糖現象,如飢餓感、眩暈、冒冷汗、顫抖、心悸、視力模糊、無力、 昏昏欲睡等,請盡快食用果汁或糖果。嚴重低血糖發生昏迷時,則不可進食, 應立即送醫。 2. 若注射部位有紅、疼痛、腫塊,應避免注射此位置。如果症狀仍持續,應告 知醫(藥)師。 參考資料:台灣胰島素注射指引 相關關鍵字:糖尿病、胰島素、針劑、注射、血糖 在過去的研究指出,針對過重肥胖但沒有糖尿病的患者,善纖達SAXENDA具有減重的效果。而且在美國(2014年核准上市),歐盟,韓國(2018年核准上市)等地獲得減重的適應症。2020年美國糖尿病學年會發表的研究發現,善纖達SAXENDA搭配運動同時進行,對於減重人士來說,減重後的一年更能有效維持體重,避免復胖的窘境發生。 研究設計 這項以S-LITE(Combined Effects of GLP-1 Analogue and Exercise on Maintenance of Weight Loss and Health After Very-low Calorie Diet)的研究,找了200名在18到65歲之間,BMI介於32到43 (kg/m^2),且沒有糖尿病,未進行胃繞道手術,且以前每週運動不到2小時的減肥人士。 在研究開始,先給參與試驗者每日800大卡的非常低熱量飲食,且長達8週的時間,其中195位患者(91%)達到減少5%以上體重。這195位患者平分成四組,分成 第一組: 每天施打3.0mg 善纖達SAXENDA(Liraglutide)搭配每週運動150分鐘 第二組: 施打安慰劑,但每週運動150分鐘 第三組: 每天施打3.0mg善纖達SAXENDA(Liraglutide)不搭配運動指導 第四組: 施打安慰劑,但不運動。 運動組包含每週有教練監督的運動兩次以及每週兩次的個人運動,達到每週150分鐘。而兩次監督的運動,包含30分鐘的高強度間歇性運動(HIIT)以及15分鐘的循環訓練(Circuit Training)。觀察一年後的體重變化。 來看看這些參與者平均年齡42歲,體重107.6公斤,BMI(身體質量指數)36.5kg/m^2, 36%的男性以及64%女性。 研究結果 在起始八週時,所有參與者平均減少13.1公斤的體重。 在一年後,來比較體重的變化 第一組:施打善纖達SAXENDA搭配運動組則額外減少了3.4公斤。 第二組:單獨運動組,復胖2.0公斤 第三組:單獨使用善纖達SAXENDA又再減少0.7公斤 第四組什麼都沒做的復胖6.1公斤 在起始八週時,所有參與者平均減少了2.3%的體脂肪。 一年後,來比較體脂的變化, 第一組:施打善纖達SAXENDA搭配運動者,減少了3.5%體脂肪。善纖達SAXENDA搭配運動組,在減少脂肪同時,也仍然保留了肌肉重量(lean muscle mass)。 第二組:單獨運動者減少1.8%體脂肪 第三組:單獨使用Liraglutide者減少1.6%體脂肪 第四組:什麼都沒做的復胖0.4%體脂 討論 減重最困難的並不是在一次能減少多少體重,而是在減重後的半年到一年開始復胖,而復胖後的體重,可能比減重前更重,體脂比減重前更高,而造成溜溜球效應。所以,如何維持減重者不復胖,也是減重者相當關心的事。 過去的研究也指出,以平均值來說,單純生活習慣的介入,在一年後的復胖比例較高,減重效果較差,而持續的藥物介入者,較能維持較久的時間不復胖。胃繞道手術則能維持非常長的時間不復胖。 這則研究簡單說的說就是指出,使用藥物善纖達SAXENDA搭配運動,不僅可以不復胖,還能減少更多的體重與體脂。 不管如何減重還是建議搭配運動,才能讓身體更好更健康! 結論 針對肥胖患者,在使用非常低熱量飲食做初期減重後,合併使用Liraglutide加上運動進行一年時間,可以有效維持體重,甚至減少更多體脂肪而不復胖。 參考資料 Liraglutide Plus Exercise Helps Maintain Weight Loss: S-LITE 底下是原文:
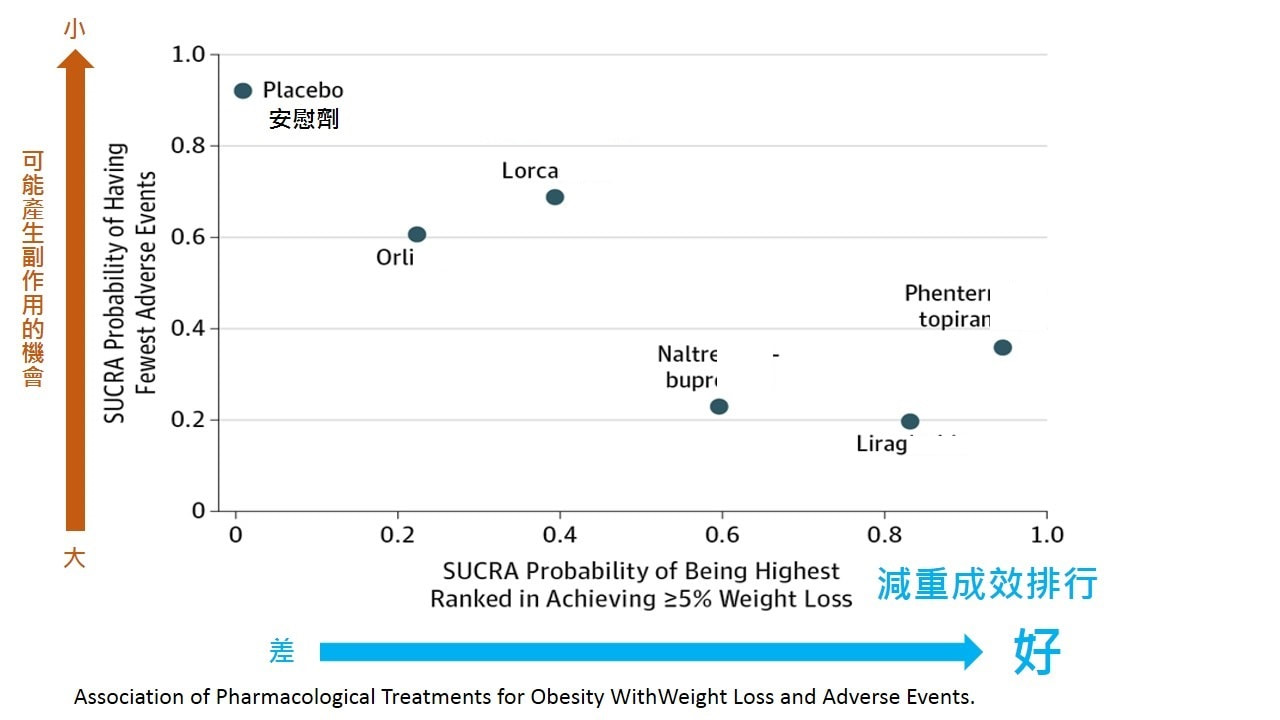
A year of regular exercise plus daily subcutaneous injections of the glucagon-like peptide-1 (GLP-1) receptor agonist liraglutide (Saxenda, Novo Nordisk) was superior to placebo or liraglutide or exercise alone in maintaining weight loss, in a new study. The S-LITE trial randomized close to 200 healthy patients with obesity but no diabetes who had lost at least 5% of their initial weight on an 8-week very low-calorie diet to one of these four treatment regimens for weight-loss maintenance. With the combined treatment, the patients not only kept the most weight off, they also lost the most body fat while preserving muscle mass. "Therefore, we recommend this combined use of exercise and liraglutide after weight loss," Julie R. Lundgren, MD, and a PhD student, concluded in her oral presentation of the trial results during the virtual American Diabetes Association (ADA) 80th Scientific Sessions. The study shows "how important it is to initiate a strategy for weight [loss] maintenance," Lundgren and senior author Signe S. Torekov, PhD, both from the University of Copenhagen, Denmark, told Medscape Medical News in an email. "It is not enough to go on a diet and lose weight," they stressed. Patients need "some kind of active treatment after the weight loss in order to maintain [this lower] weight and health benefits" that go along with it. This combined treatment would most likely also help patients with type 2 diabetes maintain weight loss, they speculated. Although, they added, "depending on how long you have had type 2 diabetes, it may be more difficult to reverse adverse effects of type 2 diabetes." Therefore, it is better to lose weight before developing diabetes (for which obesity is a risk factor). What Is the Best Way to Prevent Weight Regain? S-LITE was a randomized placebo-controlled trial designed to investigate 1-year weight-loss maintenance and change in body fat and muscle mass using four strategies in healthy patients with obesity. The trial enrolled 215 participants who were 18-65 years old with a body mass index (BMI) of 32-43 kg/m2 and no diabetes or previous bariatric surgery, who did less than 2 hours of vigorous exercise a week. On average, the participants were 42 years old, weighed 107.6 kg (237 lb), and had a BMI of 36.5 kg/m2; 64% were women. After an 8-week very low-calorie diet (800 kcal/day), 195 patients (91%) had lost the required ≥ 5% of body weight and were able to enter the maintenance phase. They were randomized to 1 year of treatment with liraglutide 3.0 mg/day; exercise 150 minutes/week (plus placebo); exercise 150 minutes/week plus liraglutide 3.0 mg/day (combination); or placebo. Participants injected themselves with either placebo or liraglutide daily (depending on what group they were in). The exercise intervention consisted of two supervised sessions per week and two individual sessions per week, to reach 150 minutes/week of activity. The supervised exercise sessions, which took place in the department of physiology, Hvidovre Hospital, consisted of 30 minutes of high-intensity interval-based cycling and 15 minutes of circuit training, guided by exercise trainers affiliated with the study. The drop-out rate was low. At 1 year, 41 of 49 randomized patients in the liraglutide group, 40 of 48 patients in the exercise group, 45 of 49 patients in the combination group, and 40 of 49 patients in the placebo group completed the study. Greatest Success With Combined Strategy At the start of the weight-loss maintenance phase, participants had lost an average of 13.1 kg. At 1 year, patients in the liraglutide only group had lost an additional 0.7 kg; patients in the exercise group had regained 2.0 kg; and participants in the placebo group had regained about half of what they had lost (6.1 kg). However, participants in the combined exercise and liraglutide group had lost an additional 3.4 kg. Moreover, participants in the liraglutide and exercise group lost fat while preserving lean muscle mass. At the start of the weight-loss maintenance phase, participants had lost an average of 2.3% of their body fat. After 1 year, participants in the combined liraglutide and exercise group had lost an additional 3.5% of their body fat — which was greater than the loss of body fat in the exercise group (1.8%) and liraglutide group (1.6%), or the gain of body fat in the placebo group (0.4%). "The compliance to both study medication and the exercise program was very high in our study," Torekov and Lundgren said, "so we consider the combined treatment strategy as feasible with the correct guidance and supervision." However, they stressed that guided exercise is especially important when initiating a program for untrained individuals, and studies have shown that it may be more difficult to adhere to long-term unsupervised exercise programs. And the cost of liraglutide may be a potential drawback for some individuals, they acknowledged. Likewise, exercising at a gym may be costly, "but it is also possible to exercise outside the gym on your own for free, for example by cycling, brisk walking, or running." Moreover, "later treatment of the comorbidities associated with obesity (type 2 diabetes, cardiovascular disease, etc) is also costly," they point out. "In general, the participants liked the treatment programs as is also reflected in the low dropout rate and high adherence to the programs," the researchers concluded. Torekov has reported receiving research support from Novo Nordisk. Lundgren has reported no relevant financial relationships. Disclosures for the other authors are listed in the abstract. ADA 2020 Scientific Sessions. Presented June 13, 2020. Abstract 139-OR. 根據2016年刊登在JAMA上的系統性綜論 (systematic review),研究學者以網絡統合分析 (network meta-analysis) 的方式分析比較了目前美國FDA核准用於減重的藥品療效,這些藥物分別是Belviq(沛麗婷)、Qsymia(在台未上市)、Saxenda(善纖達)及Xenical(羅鮮子)。 以下是比較的各個藥物比對介紹: 這個分析總共有27項隨機分派研究,有26項是與安慰劑比較,只有一項是兩個互比 (Xenical與Saxenda),分析結果顯示,減重超過5%排序第一名是Qsymia,其次是Saxenda(善纖達)。 也就是目前台灣核准的減重藥中,以機率來看成功減重超過5%的第一名是善纖達SAXENDA減重針(減肥針)。 當然不能只著重減重成效,卻忽略副作用。
在抑制慾望的減重藥品中,如Belviq(沛麗婷)或 Qsymia,大多中樞神經興奮的關係,大多有心跳加快、頭痛的問題。而透過調控胰島素的Saxenda(善纖達),則是腸胃不適(噁心、嘔吐等)。 而排油系的Xenical(羅鮮子)大多有噴油、來不及到廁所等都是油便的問題。 但是,如果對個人來說,可能因個人體質等等因素,還是會有些差異。 最後一提,成功減重機率大,當然相對的發生副作用的機率,也可能比較高。 因此,還是要注意自己在使用中是否有副作用的情況發生,所以也建議隨時聯繫您的家庭醫師或家庭藥師。 (仿單上的副作用,是大量人體試驗累積下來的數據,並不是所有的副作用都會發生,也不是所有的人都會經歷副作用的過程。) 若有任何問題,也歡迎加入新德大藥局官方LINE詢問。 重大公告
4/1(三)起 販售口罩時間調整為 早上九點半 開始販售 轉眼間清明連續假期就要到了呢😏😏 我們也會趁這段時間稍微休息一下 喘口氣 在4/3~4/5這幾天 期間"不"販售口罩 造成困擾深感抱歉🙏🙏🙏🙏 最後再囉嗦的叮嚀大家 雖然難得放長假很開心 但還是建議不要到處亂跑喔 如果有出門記得要戴口罩😷、勤洗手👏唷 #新德大藥局 #清明連續假期 #戴口罩勤洗手很重要 在2019年12月13日,魚油成分處方藥Vascepa獲FDA批准,成為第一個輔助史他汀(STATIN)類藥物療法的心血管藥。 其實,台灣目前也有藥品級魚油。 脂妙清軟膠囊1000毫克﹝Omacor Soft Capsules 1000mg)於2016年4月12日獲得台灣衛生福利部食品藥物管理署(TFDA)通過查驗登記核發藥品許可證。許可證字號:衛部藥製字第059019號,適應症為高三酸甘油酯(血)症。 藥品級魚油與食品級魚油還是有相當的大差異,沒有經過臨床實證,及使透過再多的檢驗與廣告,都還是有相當大的差異。 而且2016年在台灣已完成臨床試驗証實可有效降低三酸甘油酯,並順利取得衛福部的藥物許可證。 (在台大、北榮、中榮、成大等四家醫學中心做臨床試驗,共納入253位三酸甘油酯數值介於200至1000 mg/dL之受試者,臨床試驗証實可有效降低三酸甘油酯。) 在歐美各醫學專科(美國內分泌醫學會、歐洲心臟科醫學會、歐洲動脈硬化醫學會等)的治療指引中,也將Omega-3列為用藥選項。 若有相關問題,歡迎加入官方LINE提問。 美國心臟科學會於2017年建議,處方藥等級的Omega-3可以應用在心衰竭和冠心病,作心肌梗塞的二次預防(secondary prevention)。
國內外建議補充Omega-3的治療指引包括: 1. LDL已達標但TG仍超標之糖尿病患者 (AACE) 2. 嚴重高三酸甘油脂(TG >1000 mg/dL)患者 (AACE/臺灣動脈硬化學會) 3. 慢性腎病患者 (臺灣腎臟學會) 4. 冠心病患者 (AHA/臺灣動脈硬化學會) 5. 心衰竭患者 (AHA/ESC) 6. IgA腎炎患者 Omega-3目前在全世界各領域疾病都有臨床實驗在進行中,包括阿茲海默、老年癡呆、憂鬱症、注意力過動(ADHD)、發炎性腸道疾病、紅斑性狼瘡、氣喘、關節炎、異位性皮膚炎、青春痘、乾眼症、脂肪肝、代謝症候群等,使用的適應症應該會越來越廣。 很多人會問:不是有分甚麼三種型態TG、EE、rTG? 由於人體的的收以及作用是相當複雜,因此不是光一個吸收比較好就能說這個魚油能有降低三酸甘油脂的效果,又或者是濃度高人體就能真正去改善高三酸甘油脂的問題。 若有任何相關問提請詢問您的家庭醫師或是家庭藥師。 Belviq, Belviq XR (lorcaserin) by Eisai: Drug Safety Communication - FDA Requests Withdrawal of Weight-Loss Drug 以下是創益生技股份有限公司的聲明
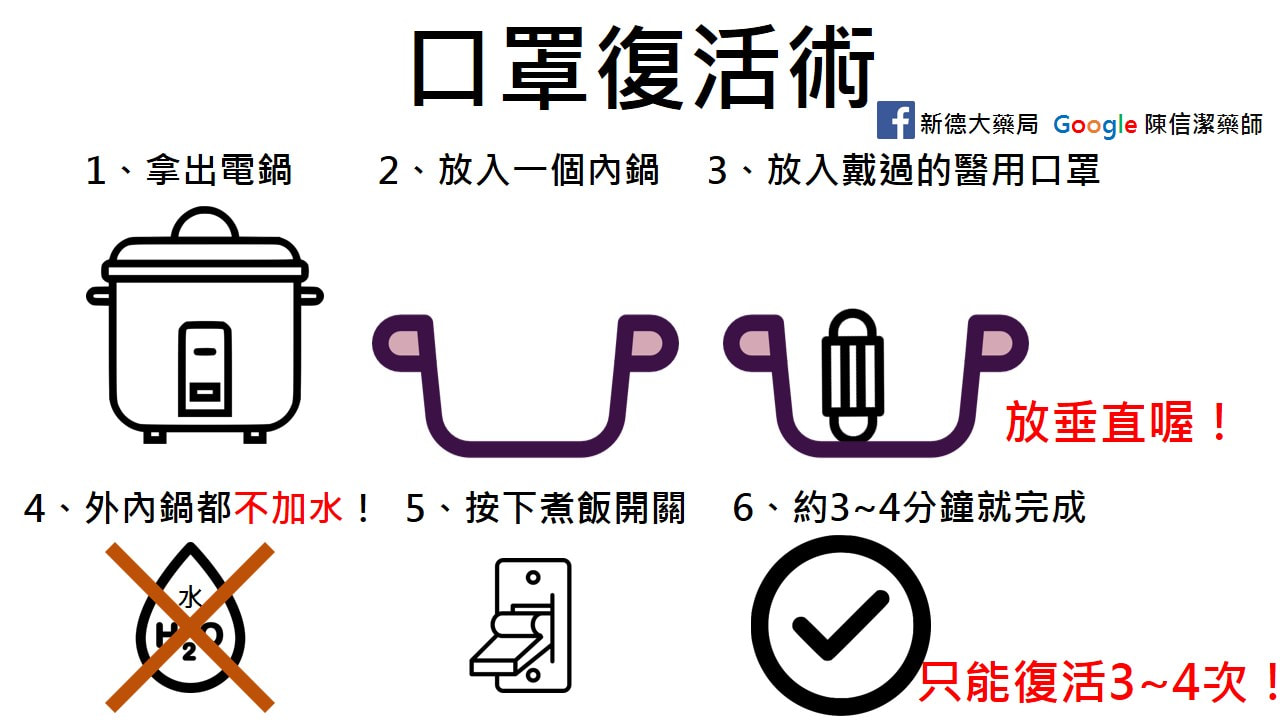
本公司(創益生技股份有限公司),針對美國FDA於2020年2月13 日發布在美國合法上市的減肥藥沛麗婷處方藥(Belviq,學名Lorcaserin)因可能增加罹癌風險,衛采製藥(Eisai)決定退出美國市場一事,說明如下: 1、 美國FDA用藥安全聲明內容指出,雖無法斷定沛麗婷Belviq(學名Lorcaserin)會導致特定癌症,但於第四期臨床試驗Camellia Study (進行五年,一萬兩千人,平均年齡64歲,平均體重為102公斤中,試驗組與對照組罹癌人數比為7.7%與7.1%,兩組數據臨床統計上無顯著差異,但原廠衛采製藥(Eisai)基於病人安全為首要條件之下,仍決定沛麗婷Belviq退出美國市場販售。 2、 本公司對於原廠衛采製藥(Eisai)決定退出美國市場的原因與資訊,因東西方時差關係,正在尋求聯繫與了解中。 3、 基於病人安全為首要條件之下,本公司也將通知醫療院所先暫停開立沛麗婷Belviq處方籤。 4、 對於已經服用或者正在服用沛麗婷Belviq的患者請不用過度恐慌,根據FDA於2020年2年13日發布的用藥安全(DSC, Drug safety communication )裡已詳載請病患停藥即可,不需立即做額外追蹤處置。 [Posted 02/13/2020] AUDIENCE: Patient, Health Professional, Pharmacy ISSUE: FDA has requested that the manufacturer of Belviq, Belviq XR (lorcaserin) voluntarily withdraw the weight-loss drug from the U.S. market because a safety clinical trial shows an increased occurrence of cancer. The drug manufacturer, Eisai Inc,. has submitted a request to voluntarily withdraw the drug. When FDA approved lorcaserin in 2012, we required the drug manufacturer to conduct a clinical trial to evaluate the risk of cardiovascular problems. A range of cancer types was reported, with several different types of cancers occurring more frequently in the lorcaserin group, including pancreatic, colorectal, and lung. BACKGROUND: In January 2020, FDA announced we were reviewing clinical trial data and alerted the public about a possible risk of cancer associated with lorcaserin based on preliminary analysis of the data. RECOMMENDATION: Patients Patients should stop taking lorcaserin and talk to your health professionals about alternative weight-loss medicines and weight management programs. It is best to dispose of unused lorcaserin using a drug take back location, but if you can’t get to one you can dispose of lorcaserin in your household trash: Mix the pills with an unappealing substance such as dirt, cat litter, or used coffee grounds; do not crush them. Place the mixture in a container such as a sealed plastic bag. Throw away the container in your trash at home. Remove or delete all personal information on the prescription label of empty medicine bottles or packaging, then throw away or recycle them. FDA is not recommending special screening for patients who have taken lorcaserin. Talk to your health care professional if you have questions. Health Professionals Health professionals should stop prescribing and dispensing lorcaserin to patients. Contact patients currently taking lorcaserin, inform them of the increased occurrence of cancer seen in the clinical trial, and ask them to stop taking the medicine. Discuss alternative weight-loss medicines or strategies with your patients. FDA is not recommending special screening for patients who have taken lorcaserin. As with any individual patient, regardless of prior lorcaserin treatment, standard screening recommendations for cancer should be implemented. 拿出家裡的電鍋,再放一個內鍋,然後放入戴過的外科口罩。 記得放垂直喔!(上面可以放筷子架著) (不能直接讓表層接觸電鍋底部加熱板,破壞防護結構。) 外層不能加水! (有水蒸氣的話,會嚴重破壞口罩的濾材,馬上就會下降50%的過濾效果。) 直接按下煮飯開關,大約3到4分鐘就好。 不影響外科口罩的過濾效力。 口罩取出來的時候呢,把它放到常溫,蒸過5次之後,它大概還有71.5%的過濾效果。 (建議只能復活3~4次) 還有噴酒精可消毒可否呢?
不建議用酒精來消毒口罩。 口罩表面噴灑酒精,酒精揮發前口罩都失去防水功能,等酒精揮發後,口罩又再度回復防水功能。 雖然酒精揮發後保有防水功能,但防菌功能是否還存在,不得而知。 記住!!千萬別戴上酒精未揮發的口罩,這樣恐會吸入更多粉塵與病菌。 政府防疫 #口罩 販售時間: 2/6下午2:00-4:00 下午2:00開始發號碼牌 2/7販售時間另行公布 ------------------------------- 領取口罩時麻煩您: 1. 請依指示排隊 不准插隊 2. 請自備零錢 3. 購買時需過卡,請耐心等候 4. 優先領藥客人如有口罩需求,請重新排隊 5. 每次進店1個人次 6. 不預留、不預售 收取的費用都是繳回國庫;完全是做志工,謝謝合作。 請體諒實行之初,網路系統不穩, 請耐心等候, 請勿喧嘩、咆哮、催促。 防疫共體時艱 健保社區藥局 無償支援政府防疫 台灣加油 優先禮讓給高風險族群 例如 這兩天沒有口罩但要回診的長輩 或醫療人員 我們無法請來領取的人提供證明 只能靠公德心跟同理心還有信任❤️ 還有提醒大家 請大家把 #酒精棉片 留給胰島素病患 #新德大藥局 #台北市松山區饒河街204號 請大家幫忙分享一下。
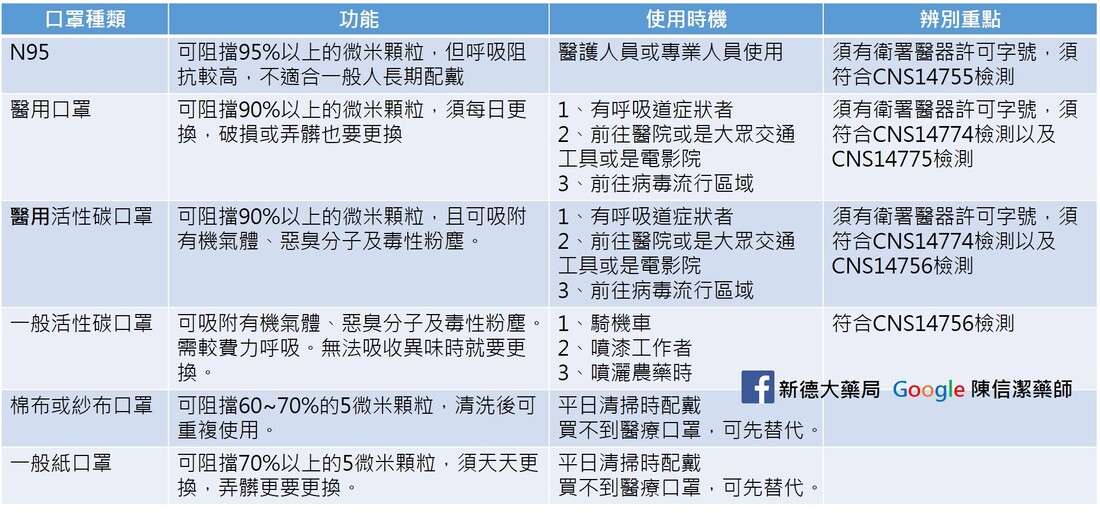
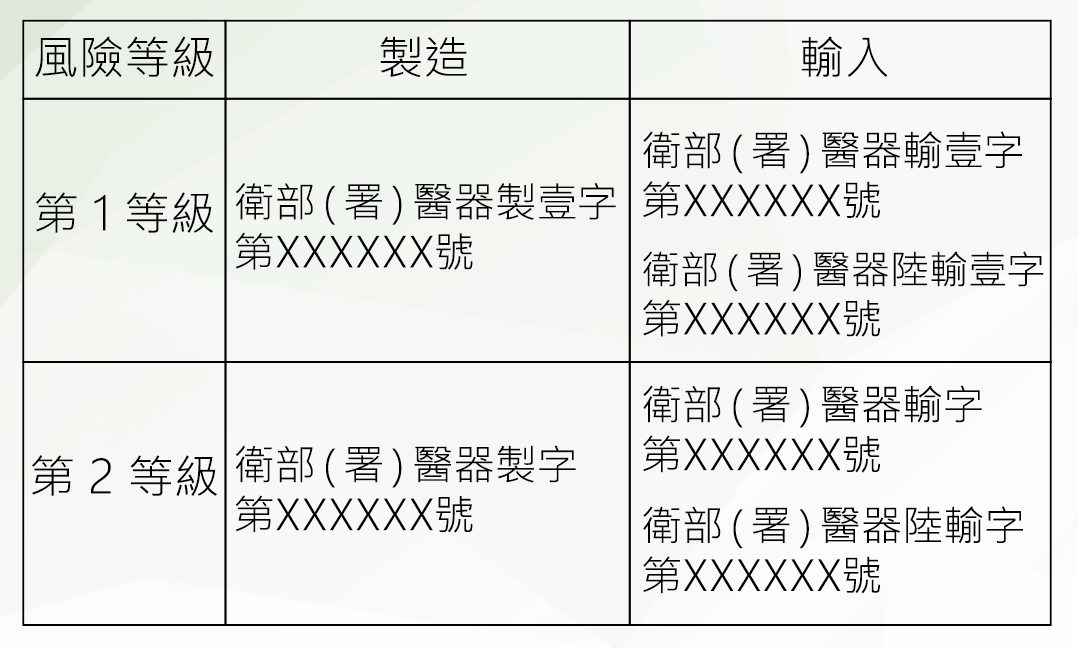
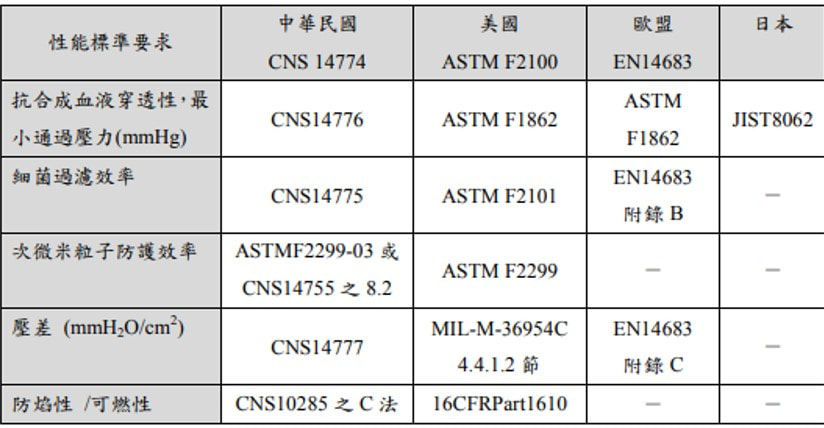
口罩只送不賣! 買到台北市藥師公會分配的兩包醫療口罩。 有需要或是急用的朋友(有些要去醫院看病卻沒有口罩的朋友)可以到藥局來拿,一人限拿一個,送完為止。 若有庫存口罩的朋友,請您留給真正需要急用的人喔! 請大家幫忙分享,讓買不到又真正需要急用口罩的朋友知道。 謝謝您的分享。 從流感經驗來看,一般外科口罩就很夠用,N95雖屬高過濾性口罩,但因要完全密封,一般民眾可能戴2分鐘就喘不上來,戴不住等於白戴。 醫護人員會戴N95口罩,是因為在做插管、侵襲性處置時,病人可能會噴濺液體,為了避免吸入造成感染,才會要求配戴。不過真的戴過後就知道,因為須完全密封,往往會造成呼吸困難,一般民眾還是戴具有物理性屏障的一般外科口罩就好,但如果有污染可能性,就要馬上更換。 來了解一下口罩 「為什麼有些口罩標示醫療器材許可證號碼呢?」沒錯!市面上部分口罩是醫用口罩,用來防止病人與醫護人員之間的微生物、體液以及粒狀物質的傳遞,依照不同功能與設計,可分為:為執行手術程序而穿戴的口罩(屬第2等級醫療器材,中風險性),以及其它醫用口罩(屬第1等級醫療器材,低風險性)。 醫用口罩規範為何? 醫用口罩皆應符合國家標準CNS14774(T5017)「醫用面罩」或其他具等同性國際標準的性能規格要求;另若標示卅宣稱具N95(等同或以上者)效果的醫用口罩者,其防護效率及呼吸氣阻抗(壓差),則改依CNS14755(Z2125)「拋棄式防塵口罩」D2等級(等同或以上者)的性能規格要求,另「阻隔PM2.5」非屬醫療效能。 那裡可購買醫療器材? 販賣醫療器材的業者,必須先取得各縣市衛生局核發的販賣業藥商許可執照,消費者購買醫療器材時,應先認明店家持有前述執照。基於醫療器材不同於一般商品,不是所有品項都合適透過通訊交易通路(包括網路、電視購物、以型錄販賣等)販售,為保障民眾健康安全,衛生福利部於106年3月16日公告得於通訊交易通路販售的醫療器材品項,第1等級與第2等級的醫用口罩,都是可以經由通訊交易通路販售的品項。 通訊交易通路應設有諮詢專線供消費者洽詢,也必須在通路明顯可見處,讓消費者辨識諮詢專線。消費者購買醫療器材時,也應注意產品資訊,如:產品名稱、許可證字號、使用方法、藥商名稱、地址、以及許可證字號等。 如何分辨醫療器材許可證字號? 不論是本國製造或由外國輸入的醫療器材,都必須取得衛生福利部核發的醫療器材許可證,並列有字號,如下表: 戴口罩重點提醒
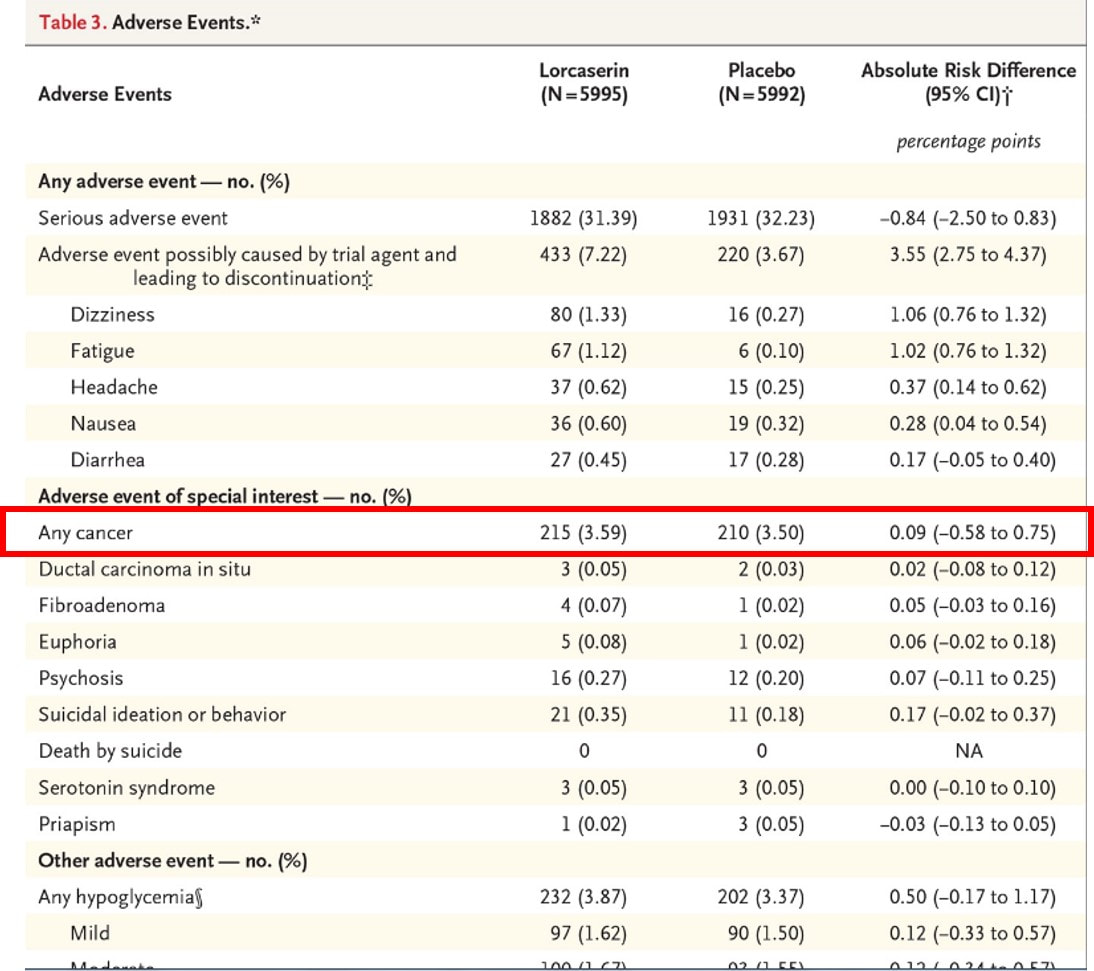
口罩得挑有99%隔絕細菌功能的,尤其口罩每天都要換,手也別碰觸到白色吸水區。 V基本款外科口罩 X黑色特殊布料材質 X活性碳系列 這2款對武漢肺炎防治都沒效 至於N95有需要嗎?一般醫用口罩即可 一般在公共場所走來走去,你不需要用這個,因為沒有人會直接,朝你的臉,直接分泌物跑到你的臉上面。 戴口罩要配合臉部大小,要密合!!(小孩要帶小孩專用的) 要注意手細菌多別摸白色內層 不要戴反或戴了不遮口鼻 戴口罩打噴嚏就要換新口罩! (一打噴嚏,你的口罩濕了就濕了,分泌物汙染的口罩,本身就變細菌,不適合再戴了。) 拿的時候拉耳掛橡皮筋或是耳掛,也避免摺起來放包包,打噴嚏就要換新,或是戴一天也得淘汰,因為外科口罩外層有防水效果,若濕了髒了都不OK,別讓辛苦悶著口鼻防疫,最後效果卻沒達到。 如果對詳細資料不感興趣的,可以直接看結論。 Drug Safety Communication - Due to Possible Increased Risk of Cancer 美國 FDA 在2020年1月14日發佈藥品安全警訊,大型隨機分派研究結果顯示,可能增加癌症風險!! 根據臨床的報告,受試者在3.3年的隨機試驗中,服用沛麗婷和安慰劑治療的患者,在新血管風險上無明顯差異,。 根據醫學博士Erin Bohula博士(馬薩諸塞州波士頓的布萊根婦女醫院)的介紹,在2018年歐洲心髒病學會大會上發表了試驗結果,當時沒有發現會增加致癌風險或加重精神疾病的副作用。 但在對該試驗進行了5年的後續訪查中,結果發現服用沛麗婷治療的患者中,罹患癌症的比例有所增加, 因此美國FDA在官網中發表該聲明:持續追蹤上市後的各項臨床數據。 也就是說,目前只是懷疑,FDA都尚未下定論,目前只是就上市後持續追蹤,來做一個提醒與警示。 每個藥品上市前後,都會持續追蹤各項臨床研究,癌症也是其中的一環,目前不必過度擔心。 至於在上市前的第三期臨床試驗:沒有增加罹癌風險的報告 在上市後的臨床研究(PMS):也沒有離癌風險的報告 而且FDA並沒有更進一步要求致癌風險的臨床研究。 加上根據臨床收錄的12000人中,都是年紀較大(平均年齡64歲),且肥胖(平均BMI=35,體重102公斤) 而且這個CVOT:Camellia Trial報告中,沛麗婷組只比安慰劑組多5例。在統計顯著性的實質意義,因此,不宜過度解讀。(215 V.S. 210) A Study to Evaluate the Effect of Long-term Treatment With BELVIQ (Lorcaserin HCl) on the Incidence of Major Adverse Cardiovascular Events and Conversion to Type 2 Diabetes Mellitus in Obese and Overweight Subjects With Cardiovascular Disease or Multiple Cardiovascular Risk Factors (CAMELLIA-TIMI)
(https://www.clinicaltrials.gov/ct2/show/NCT02019264) Cardiovascular Safety of Lorcaserin in Overweight or Obese Patients (https://www.nejm.org/doi/full/10.1056/NEJMoa1808721) (https://www.nejm.org/doi/full/10.1056/NEJMoa1808721) 可以看出肥胖本身,就是罹癌風險的因子。 結論:在上市後,持續追蹤滿5年的研究中,在年紀較大(平均年齡64歲),且肥胖(平均BMI=35,體重102公斤)發現罹患癌症的比例有所增加,但是是否因沛麗婷導致癌症,FDA也不清楚,還有待FDA更進一步的消息。 未來,若有任何更新的任何資訊,將第一時間為大家來追蹤。 歡迎追蹤新德大藥局的FB或是官網,隨時為您更新最資訊。 目前有很多藥品都有被FDA警示過,降血糖藥exenatide (Byetta, Bydureon), liraglutide (Victoza), sitagliptin (Januvia, Janumet, Janumet XR, Juvisync), saxagliptin (Onglyza, Kombiglyze XR), alogliptin (Nesina, Kazano, Oseni), and linagliptin (Tradjenta, Jentadueto)、GnRH agonists、治療骨質疏鬆的雙磷. 酸鹽類(Bisphosphonate)藥等。這些藥品,目前也都持續使用,而且尚未停止使用或下架,所以不用過度解讀。 (https://www.fda.gov/drugs/drug-safety-and-availability/fda-drug-safety-communication-fda-investigating-reports-possible-increased-risk-pancreatitis-and-pre) 以下是美國FDA原文: [Posted 01/14/2020] AUDIENCE: Patient, Health Professional, Pharmacy ISSUE: The FDA is alerting the public that results from a clinical trial assessing safety show a possible increased risk of cancer with the weight management medicine Belviq, Belviq XR (lorcaserin). At this time, the cause of the cancer is uncertain, and we cannot conclude that lorcaserin contributes to the cancer risk. However, we wanted to make the public aware of this potential risk. We are continuing to evaluate the clinical trial results and will communicate our final conclusions and recommendations when we have completed our review. BACKGROUND: Lorcaserin is a prescription medicine approved by FDA in 2012 for use with a reduced-calorie diet and increased physical activity to help weight loss in adults who are obese or are overweight and have weight-related medical problems. Lorcaserin works by increasing feelings of fullness so that less food is eaten. It is available as a tablet (Belviq) and an extended-release tablet (Belviq XR). RECOMMENDATION: Health care professionals should consider if the benefits of taking lorcaserin are likely to exceed the potential risks when deciding whether to prescribe or continue patients on lorcaserin. Patients currently taking lorcaserin should talk to their health care professionals about the potential increased risk of cancer with use of lorcaserin. Health care professionals and patients are encouraged to report adverse events or side effects related to the use of these products to the FDA's MedWatch Safety Information and Adverse Event Reporting Program:
https://www.fda.gov/safety/medical-product-safety-information/belviq-belviq-xr-lorcaserin-drug-safety-communication-due-possible-increased-risk-cancer 以下是官方聲明 |
依主管機關相關規定,專業醫藥資訊僅提供醫藥專業人員參考(請申請核可通過後,即可閱讀專業人員區)。
恕不對外開放非專業人士使用。 每月文章
一月 2023
類別 |
營業時間:週一至週日(全年無休) 早上九點至晚上十一點四十分 (09:00~23:40)
|
地址:台北市松山區饒河街204號
|
聯絡我們 |








 RSS 訂閱
RSS 訂閱
